About Molecular Biology
Moleküler biyoloji, biyokimya ve hücre biyolojisi hakkında detaylı bilgiler içeren moleküler biyoloji ve genetik öğrencisi tarafından hazırlanan bir blog.
16 Nisan 2019 Salı
Moleküler Biyoloji ve Hücre Biyolojisi ile İlgili Hafıza Kartları | Memory Cards about Molecular Biology and Cellular Biology 2
Tekrar etmek hem benim uyguladığım ve çok faydalı bulduğum bir teknik hem de bilimsel olarak bir bilginin kalıcı olmasında çok etkili olduğu kanıtlanmış bir teknik. Bu yazı aracılığıyla paylaştığım hafıza kartlarından hem yeni bir şeyler öğrenebilir hem de ara ara bu hafıza kartlarına geri dönerek öğrendiğiniz şeyleri kalıcı hale getirebilirsiniz. Umuyorum ki sizler için de faydalı olur, sevgilerle.
22 Mart 2019 Cuma
Metabolizma | Anabolik ve Katabolik Yollar, ATP, NAD+, FAD ve CoA
Hücrede temel olarak iki tip metabolik olay gerçekleşir: Anabolik olaylar (yapım olayları) ve katabolik olaylar (yıkım olayları). Katabolik reaksiyonlarda atomlar arası bağlar kırılır -örneğin midede proteinlerin amino asitlerine parçalanması sırasında amino asitler arasındaki peptit bağlarının kopması- ve bu kopma sonucunda bir enerji açığa çıkar. Kısacası katabolik reaksiyonlarda ΔG negatiftir. Bunun tam tersi olarak anabolik reaksiyonlarda atomlar arası yeni bağlar kurulur ve küçük parçalar bir araya getirilip büyük parçalar oluşturulur -örneğin hücrede translasyon esnasında amino asitlerin peptit bağıyla bir araya gelip proteinleri oluşturması- ve bu yeni bağların oluşturulması için enerjiye gereksinim duyulur. Kısacası anabolik reaksiyonlarda ΔG pozitiftir.
Hücredeki bazı yolaklar hem anabolik hem de kataboliktir yani hem yapım hem de yıkım reaksiyonlarını içerirler ve amfibolik olarak adlandırılırlar.
Katabolik reaksiyonların en önemlisi karbon yakıtların özellikle glukoz ve yağ asitlerinin oksitlenmesidir. Oksitlenme esnasında -örneğin, metan -> metanol -> formaldehit -> formik asit -> karbondioksit- enerji açığa çıkar çünkü bu oksitlenme esnasında belli bir enerjiye sahip olan elektronlar maddeden koparılır, düzenli halden düzensiz hale geçilir, entropi artar ve serbest enerji azalır.
Anabolik reaksiyonlarda ise düzensizlikten düzenli hale geçilir, yani entropi azalır ve serbest enerji artar. Tüm bunların olabilmesi için de yüksek enerjili elektronlara veya ATP gibi moleküller tarafından verilebilecek enerjiye ihtiyaç duyulur.
Yukarıdaki resimde de görülebileceği üzere metabolizma çok karmaşık bir yapıya sahiptir fakat bu yazıda da üzerinde durulacağı gibi metabolik yollar çok fazla ortak motife sahiptir, örneğin ATP, NAD+, FAD ve Coa. [ Çok detaylı olduğu için bu yazıda bu yolakların nasıl keşfedildiği üzerinde durulmayacaktır. Fakat nasıl hücrede hangi genlerin bulunduğuna dair araştırmalar yapan "genomics", hangi RNA'ların bulunduğuna dair araştırmalar yapan "transcriptomics" gibi alanlar varsa hücrede hangi metabolitlerin bulunduğuna dair ( genellikle mass spectrometry'yi kullanarak) araştırmalar yapan "metabolomics" adlı bir alan vardır.]
ATP:
Yukarıda da bahsedildiği gibi hücrede enerji salan katabolik reaksiyonlar (ΔG<0 font=""> ve enerjiye ihtiyaç duyan anabolik reaksiyonlar (ΔG>0) gerçekleşmektedir. Ve tahmin edebileceğiniz üzere bu iki reaksiyon arasında enerjiyi iletebilecek bir moleküle ihtiyaç duyulmaktadır.
ATP adenin bazına ve alfa, beta, gama olarak adlandırılan fosfat gruplarına bağlı ribozdan oluşur ve hücrede yukarıda bahsedilen enerji taşınımı yani "energy coupling" görevini üstlenir.
ATP'nin hidrolizi ( yani gama fosfatın ATP'den ayrılması ) olayı çok büyük ve negatif ΔG değerine sahiptir. Bir başka değişle ATP'nin hidrolizi sırasında büyük miktarda enerji salınımı gerçekleşir. Eğer bu hidroliz endegonik reaksiyonlarla birleştirilirse endergonik reaksiyonlar enzimler tarafından katalizlenebilir. Kısacası, katabolik reaksiyonlar esnasında ATP üretilir yani bu reaksiyonlarda açığa çıkan enerji gama ve beta fosfat arasında bulunan fosfoanhidrid bağında depolanır ve anabolik reaksiyonlarda yüksek enerji depolayan fosfoanhidrid bağı yıkılarak negatif ΔG değeri elde edilir.
Yukarıda anlatıldığı gibi ATP'nin enerji taşıyıcısı olarak kullanılmasının nedeni büyük ve negatif ΔG değerine sahip olmasıdır, bu değerin sebebi ise şunlardır:
- ATP üç adet negatif yüke sahip fosfat grubu bulundurmaktadır. Bu da ATP içerisinde elektrostatik itme kuvvetine sebep olmaktadır.
- Hidroliz olayı hücrede entropinin artmasını sağlamaktadır.
- Hidroliz sonucu oluşan inorganik fosfat solüsyon içerisinde resonans yaparak ATP'nin içerisinde bulunduğundan daha stabil bir durumda bulunmaktadır.
- Hidrolizden sonra su molekülleri ADP ve P'ye bağlanarak onları stabil hale getirmektedir.
Burada belirtmek gerekir ki ATP'nin enerji taşıyıcısı olarak kullanılmasının bir diğer sebebi kinetik olarak çok stabil olmasıdır. Bir başka değişle herhangi bir enzim yokken ATP hidrolizi gerçekleşmez.
NAD+ / NADH ( Nikotinamid Adenin Dinükleotit ) FAD / FADH2 ( Flavin Adenin Dinükleotit) :
NAD+ ve FAD yüksek enerjili elektron taşıyıcılarıdır.
NAD+ (Nikotinamid Adenin Dinükleotit) adından da anlaşılabileceği üzere iki nükleotitin bir araya gelmesinden oluşur. Bu iki nükleotitten bir tanesi RNA'nın da yapıtaşı olan AMP iken diğeri organik baz olarak niasin vitamininden türeyen nikotinamidi içeren nükleotittir.
Organik moleküller -örneğin Krebs döngüsü esnasında acetil- oksitlenirken bu moleküllerden kopan iki adet elektron bir adet hidrojen ile birlikte NAD+ 'a verilir ve NADH oluşturulur. Daha sonradan NADH bünyesinde bulundurduğu elektronları ya kristada bulunan elektron taşıma sistemine aktarır ve ATP sentezini sağlar ya da başka bir yolakta redükleyici ajan olarak görev yapar. Kısacası, yüksek enerjili elektronları taşıma görevini üstlenir.
FAD ( Flavin Adenin Dinükleotit) de NAD+ gibi iki adet nükleotitten oluşturmaktadır. Bu nükleotitlerden biri AMP iken diğeri riboflavin vitamininden türeyen bir nükleotittir.
FAD aynı NAD+ gibi yüksek enerjili elektronları taşımaktan sorumludur. Fakat arada iki temel vardır:
- FAD redüklenirken iki yüksek enerjili elektronla birlikte iki adet hidrojen alır ve FADH2'ye dönüşür.
- FADH2 oluşturmak için gereken serbest enerji miktarı NADH oluşturmak için gerekenden daha azdır.
Aynı ATP gibi, NADH ve FADH2 kinetik olarak çok stabil moleküllerdir. Bir başka değişle hem NADH hem de FADH2 gerekli proteinler olmadan taşıdığı yüksek enerjili elektronları ortama bırakmaz.
CoA:
En önemli görevi, pirüvatın ya da yağ asitlerinin oksitlenmesi sonucu oluşan asetil grubuna bağlanıp asetil CoA olarak Krebs döngüsünde rol almasıdır.
Referanslar:
Alberts, B. (2018). Essential Cell Biolog. Essential Cell Biolog. Garland Science. https://doi.org/10.1201/9781315815015
Berg, J. M., Tymoczko, J. L., & Stryer, L. (2002). Biochemistry (5th ed.). Vasa (5th ed.). New York: W.H.Freeman & Co Ltd.
Referanslar:
Alberts, B. (2018). Essential Cell Biolog. Essential Cell Biolog. Garland Science. https://doi.org/10.1201/9781315815015
Berg, J. M., Tymoczko, J. L., & Stryer, L. (2002). Biochemistry (5th ed.). Vasa (5th ed.). New York: W.H.Freeman & Co Ltd.
9 Mart 2019 Cumartesi
Moleküler Biyoloji ve Hücre Biyolojisi ile İlgili Hafıza Kartları | Memory Cards about Molecular Biology and Cellular Biology
Tekrar etmek hem benim uyguladığım ve çok faydalı bulduğum bir teknik hem de bilimsel olarak bir bilginin kalıcı olmasında çok etkili olduğu kanıtlanmış bir teknik. Bu yazı aracılığıyla paylaştığım hafıza kartlarından hem yeni bir şeyler öğrenebilir hem de ara ara bu hafıza kartlarına geri dönerek öğrendiğiniz şeyleri kalıcı hale getirebilirsiniz. Umuyorum ki sizler için de faydalı olur, sevgilerle.
20 Şubat 2019 Çarşamba
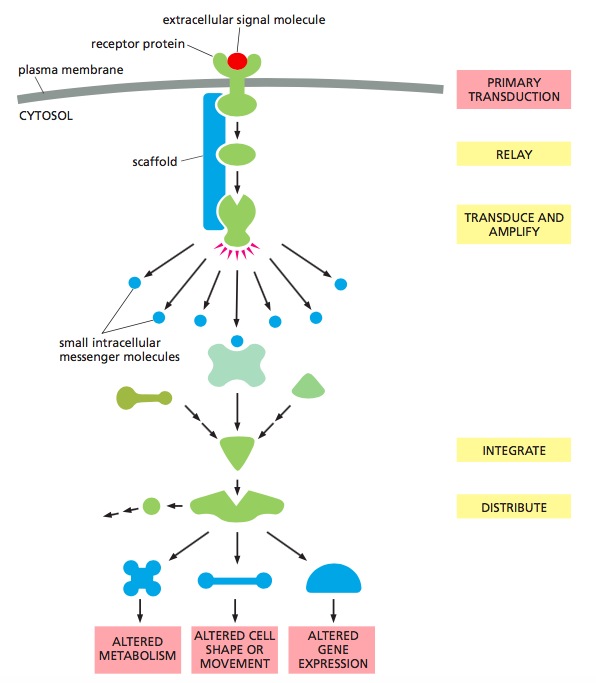
G-Proteine Bağlı Reseptörler ve Sinyal Yolakları
G-proteine bağlı reseptörler oldukça büyük bir protein ailesini oluşturmaktadır. Örnek vermek gerekirse, insan genomu yaklaşık 800 adet GPCR ( G-protein coupled receptor = G-proteine bağlı receptör) kodlamaktadır. Bu reseptörlerin hepsi hücre zarında G-proteinine bağlı bulunur ve 7 TM ( Transmembrane = transmembran yani hücre zarını boydan boya geçen ) yapıya sahiptir.
Vücutta hormon aktivasyonu, hormon salınımı, kemotaksis, ekzositoz, hücre büyümesi ve farklılaşması vb. gibi önemli ve çeşitli rolleri olan GPCR'lar şu zamana kadar dizayn edilmiş ilaçların 1/3 'ü tarafından hedef alınmıştır. Burada ayrıca belirtilmelidir ki ilaç dizaynı sırasında en çok zorlanılan adım membrandan ayrıldığı zaman yapısı bozulan GPCR'ları izole etmektir.
GPCR'ların en bilinen örneklerinden biri görmemizde büyük rol oynayan -yukarıdaki resimde yapısı gösterilen- rodopsin proteinidir.
Yukarıda sürekli olarak bahsedilen ve GPCR'lara bağlı bulunan G-protein aslında heterotrimerik G-proteindir. [ Bunun özellikle belirtilmesi gerekli çünkü monomerik G-proteinler heterotrimerik G-proteinlerden oldukça farklıdır ve aynı heterotrimerik G-proteinler gibi fizyolojik olarak çok önemlidir.] Heterotrimerik G-protein isminden de anlaşılabileceği üzere ( hetero = aynı olmayan, tri = 3) 3 farklı alt birimden meydana gelmiştir: alfa, beta ve gama. Normal şartlar altında yani ligand reseptöre bağlı değilken bu üç alt birim bir arada ve reseptöre bağlı bulunur. Ayrıca resimde de görülebileceği gibi alfa ve gama alt birimleri kovalent bağlı lipidleri sayesinde membrana da bağlı bulunur.
Reseptöre ligand bağlandığında ise öncelikle reseptörün konformasyonu değişir. Ve bu değişiklik ona bağlı bulunan heterotrimerik G-proteininde konformasyon değişikliğine yol açar. Tüm bu olayların sonucunda G-proteinin alfa alt biriminde bağlı bulunan GDP, GTP ile yer değiştirir, alfa, beta ve gama alt birimleri reseptörden ayrılır. Beta ve gama alt birimi bir arada durmaya devam ederken alfa alt birimi beta-gama kompleksinden ayrılır. Ayrıca belirtilmelidir ki G-proteinler GDP bağlı iken her zaman inaktif, GTP bağlı bulunurken ise aktiftir. Özet olarak olan tüm bu değişimlerden sonra GTP bağlı bulunan alfa alt birimi sinyal yolundaki bir sonraki adımı aktifleştirmeye hazırdır.
*Detay bilgi: Yukarıda anlatılan alfa alt birimi üzerindeki GDP'nin GTP ile yer değiştirmesi normalde GEF diye bilinen başka bir protein tarafından yapılmaktadır. Burada ise GPCR yani G-proteine bağlı reseptör GEF gibi davranıp GTP'nin lokalizasyonunu sağlamaktadır.
Alfa alt birim tarafından aktifleştirilecek diğer adım tamamen G-proteinin çeşidine bağlıdır. Eğer G-protein, Gs protein ise beta-gama kompleksinden ayrılan alfa alt birim hücre zarında bulunan adenilat siklaz enziminin yanına giderek onu aktive eder. Adenilat siklaz enzimi ise ATP'den cAMP sentezler ve cAMP molekülleri [ cAMP en önemli ikincil mesajcılardan biridir.] hücre içerisinde çeşitli yolakları tetikler.Bu yolaklardan en önemlisi PKA (Protein kinase A or cAMP dependent kinase) enzimini içerir. PKA cAMP bağlandığından aktifleşen bir kinazdır. Bir başka deyişle cAMP bağlı PKA hücre içerisinde çeşitli proteinleri fosforlayarak onları aktive veya deaktive eder.
Gs proteini tarafından aktive edilen ve ikincil mesajcı olarak cAMP içeren bu yolağın en önemli özelliklerinden biri gelen sinyali amplifiye etmesidir. Bu amplifikasyonun nedeni ise adenilat siklaz enziminin birden fazla hatta çokça cAMP sentezlemesi ve PKA enziminin birden fazla proteini fosforlayabilmesidir.
Tabii ki fosforlanan proteinler sayesinde belli bir cevap oluşturulduktan bir müddet sonra bu sinyal yolağının durdurulması gerekir. Durdurulma cAMP moleküllerinin fosfodiesteraz enzimi ile parçalanmasıyla ve alfa alt biriminin kendi üzerinde bulunan GTP molekülünü hidrolize etmesiyle başarılır.
*Detay bilgi: Her ne kadar alfa alt birimi GTPase aktivitesine sahip olsa da bu hidroliz normalde GAP adı verilen bir proteinden indüklenir. Burada ise genellikle GAP proteini görev almaz. GTP hidrolizi başka bir enzim örneğin adenilat siklaz ile olan etkileşimle indüklenir.
Gq da bir heterotrimerik G-protein çeşididir ve adenilat siklaz enzimini aktive eden Gs proteininin aksine Gq fosfolipaz C enzimini aktive eder. Fosfolipaz C enzimi aynı adenilat siklaz enzimi gibi hücre membranında konumlanır. Görevi ise hücre membranında bulunan PIP2 adlı fosfolipidi diaçilgliserol ve IP3 oluşturacak şekilde parçalamaktadır.
Kısaca ligand reseptörü, reseptör G-proteini, G-protein alfa alt birimi aracılığıyla fosfolipaz C enzimini, fosfolipaz C enzimi ise PIP2 fosfolipidini aktive eder. Ardından suda çözünebilen IP3 sitoplazmaya doğru yayılır ve ER membranında bulunan ligand-bağlı Ca++ kanallarını açar yani sitoplazmadaki Ca++ konsantrasyonunu arttırır. Ca++ iyonları hem kalmoduline bağlarak hem de hücre zarında kalan DAG ( diaçilgliserol ) ile birlikte yine hücre zarında konumlanan protein kinaz C enzimini aktive ederek hücrenin liganda cevap vermesini sağlar.
Gq ve Gs gibi heterotrimerik G proteini olan Gi proteinini içeren sinyal yolağında diğerlerinden farklı olarak bir sonraki adımın aktifleşmesi alfa alt birim yerine beta-gama kompleksi aracılığıyla yapılır. Ligandın reseptöre bağlanmasıyla aktifleşen beta-gama kompleksi hücre zarında bulunan ligand-bağlı iyon kanallarına bağlanarak onları aktifleştirir. Yani sitoplazmadaki iyon konsantrasyonunu değiştirerek hücrenin gelen sinyale cevap vermesini sağlar.
Referans: Essential Cell Biology 4th Edition ( Bu linkten indirilebilir: http://www.academia.edu/33910466/ESSENTIAL_CELL_BIOLOGY_ESSENTIAL_CELL_BIOLOGY )
18 Ocak 2019 Cuma
Proteinlerin Yapıtaşları: Amino Asitler
Proteinler vücudumuzda hormon olarak, nörotransmitter olarak, hücre iskeletinde, hücre membranında, transkripsiyon faktörü olarak, katalizör olarak vb. hem yapısal hem de reaksiyonlara yardımcı birçok işte görev alır. Canlılık için bu kadar önemli olan proteinler amino asitlerin peptit bağıyla birbirine bağlanmasıyla oluşur.
Amino asitler temelde alfa karbonuna bağlı amino grubu, karboksil grubu, hidrojen ve amino asitlerde değişik gösteren -R grup yani değişken gruptan oluşmaktadır. Öncelikle bünyelerinde hem baz olan amino grubunu hem de asit olan karboksil grubunu içerdiklerinden amino asitler amfoterik yani hem asit hem de baz gibi davranan molekül olarak adlandırılır.
Buna ek olarak, hem amino hem de karboksil grubu pH'a bağlı olarak iyonlaşabildiği için amino asitlerin net yükleri bulundukları solüsyonun pH'ına göre değişmektedir. Yukarıda bir örneği olan titrasyon grafikleri aracılığıyla bilinen pH'ta amino asitlerin yükleri tespit edilebilir.
Yukarıda da belirtildiği gibi -R grup amino asitten amino asite değişmektedir. Ve amino asitler içerdikleri -R grubunun özelliklerine göre hidrofobik, polar nötr, asidik ve bazik olmak üzere 4 temel kategoriye ayrılır.
Hidrofobik amino asitler glisin, alanin, valin, lösin, izolösin, metiyonin, fenilalanin ve triptofandan oluşmaktadır. Hidrofobik oldukları için sitoplazmik proteinlerin genellikle iç kısımlarında membran proteinlerinin ise genellikle dış kısımlarında bulunmaktadırlar.
Glisin amino asidi amino asitlerin en basit olanıdır. -R grup olarak hidrojen içermektedir. Bu yüzden de alfa karbonu kiral karbon [ Kiral karbona bağlı olan 4 grup birbirinden farklı olmalıdır.] değildir. Bir başka deyişle glisin optik olarak aktif bir molekül değildir.
Metiyonin diğer amino asitlerden farklı olarak değişken grubunda kükürt atomu bulundurmaktadır.
Fenilalanin ve triptofan amino asitleri aromatik zincir içerdikleri için aromatik amino asitler grubunda bulunurlar. Ve yine bu aromatik zincirlerinden dolayı 280 nm'de ışık absorbe ederler. Bu özellik laboratuvarlarda test tübünün içerisindeki proteinin konsantrasyonunu ve saflığını ölçmek için kullanılmaktadır.
Polar-nötr amino asitler serin, treonin, tirozin, asparajin, glutamin ve sisteinden oluşmaktadır.
Serin, treonin ve tirozin amino asitleri -OH grubu içerdikleri için proteinler açısından oldukça önemlidir. Çünkü bu -OH grubu sayesinde proteinlere serin, treonin ve tirozin amino asitlerinden fosfor grubu eklenebilir. Bu olay fosforilasyon olarak adlandırılır ve proteinlerin fonksiyonunu düzenlemede oldukça önemli görevi olan bir post-translasyonel modifikasyondur.
Konuyla ilgili daha ayrıntılı olarak şunlar da söylenmelidir; Proteinleri fosforlayan enzimler kinaz olarak adlandırılır. Ve kinazlar temel olarak ikiye ayrılır; serin/treonin ve tirozin kinazlar. Tirozin kinazlar genellikle hücre bölünmesi ve büyümesi ile ilgili olan proteinleri düzenlemede görev alırlar. Bunun doğal bir sonucu olarak da mutasyonları genellikle kansere yol açmaktadır.
Ayrıca fenilalanin ve triptofan gibi tirozin de aromatik amino asitler grubundan yer almakta dolayısıyla 280 nm'de ışık absorbe etmektedir.
Polar amino asitlerden sistein amino asidi de proteinler için oldukça büyük bir önem arz etmektedir. Çünkü sistein amino asitleri -SH grubuna sahiptir ve iki sistein amino asidi bir araya geldiğinde oksidasyon olursa -S S- yapıda olan disülfit bağı oluşur. Disülfit bağı kovalent bağ olduğundan proteinlerin konformasyonunu stabil tutmada oldukça önemlidir.
Asidik amino asitler aspartik asit ve glutamik asitten oluşmaktadır. Bu amino asitler alfa karbona bağlı olan karboksil grubuna ek olarak -R gruplarında da karboksil grubu içermektedir. Bu sebepten de fizyolojik pH'ta yani pH=7.4'te negatif yüklü olarak bulunmaktadırlar.
Bazik amino asitler histidin, arjinin ve lizin amino asitlerinden oluşmaktadır.
Histidin -R grup olarak imidazol grubu içermektedir. İmidazol grubu amino grubu içerdiğinden histidin amino asidi fizyolojik pH'ta pozitif olarak yüklenmektedir. Ayrıca imidazol grubu Ni ve Zn metal atomlarıyla bağ yaptığından DNA rekombinant teknolojisinde his tagler daha sonradan IMAC ( Immobilized Metal Affinity Chromatography) yani immobilize metal affinite kromatografisi kullanarak purifiye etmek için kullanılmaktadır.
Arjinin ve lizin amino asitleri de histidin amino asidi gibi ekstra amino grubu içerdiğinden fizyolojik pH'ta pozitif yüklüdür. Bu yüzden de özellikle DNA ile etkileşime girecek olan proteinler [DNA negatif yüklü olduğundan ] yüksek oranda arjinin ve lizin içermektedir.
Uluslarası platformlarda ve protein sekanslarında yukarıda bahsedilen amino asitler ya 3 harfli kısaltmalarıyla ya da tek harfli kısaltmalarıyla ifade edilmektedir.
Yukarıda bahsedilen 20 farklı amino asit kodlandıkları mRNA'ya göre değişik sıralarda peptit bağı ile bir araya gelir ve proteinleri oluştururlar. Peptit bağının yapısı yukarıdaki resimdeki gibidir, yani bir amino asitin karboksil grubunun -OH grubunu diğer amino asitin amino grubunun ise -H'ını kaybetmesi sonucu yani bir suyun çıkması sonucunda oluşmaktadır. Ayrıca peptit bağı rezonans sonucu yarı çift bağ karakterine sahip olduğundan oldukça stabildir.
14 Ocak 2019 Pazartesi
Poliakrilamid Jel Elektroforezi
Elektroforez elektrik alan kullanarak nükleik asit ve proteinleri porlu yapıya sahip bir jelde ayıran ve böylece onları analiz etmemizi sağlayan bir methoddur. http://aboutmolecularbiology.blogspot.com/2017/06/agaroz-jel-elektroforezi.html adlı yazıda anlatıldığı gibi nükleik asitleri analiz etmek için agardan yapılan bir jelin kullanıldığı agaroz jel elektroforezi kullanılır. Proteinleri analiz etmek için ise bu yazıda anlatılacak olan poliakrilamid jel elektroforezi kullanılır.
Öncelikle agaroz jel elektroforezinden en büyük fark olarak poliakrilamid jel elektroforezinde proteinler agaroz jel yerine akrilamid ve bisakrilamid adlı alt birimlerden oluşan poliakrilamid jelde hareket ederler. Poliakrilamid jelin agaroz jelden farklılıklarından bir tanesi daha küçük porlar içermesidir. Böylece poliakrilamid jel aracılığıyla daha küçük maddeler ayrıştırılabilir.
Poliakrilamid jelin oluşturulması için öncelikle akrilamid ve bisakrilamid ( Burada akrilamid ve bisakrilamidin oranları oldukça önemli. Örneğin, eğer proteinler ayrıştırılacaksa 40:1 (akrilamid:bisakrilamid), nükleik asitler ayrıştırılacaksa 19:1 oranı kullanılmalıdır.) uygun bir tampon solüsyonla birlikte bir tübe konulur ve polimerizasyonlarını sağlamak amacıyla APS ve TEMED eklenir. Ayrıca belirtilmelidir ki akrilamid hem bir nörotoksin hem de kanserojen madde olduğundan jelin hazırlanışından analizine kadar her adımda gerekli güvenlik önlemleri alınmalıdır.
Agaroz jel elektroforezinin aksine poliakrilamid jel elektroforezinde jel dikey olarak dökülür ve iki temel katmana sahiptir: Yığma jeli ( stacking gel ) ve ayırma jeli ( separating gel ). Yığma jeli jelin üst kısmında bulunur ve pH'ı ayırma jeline göre daha düşüktür, pH= 6.8. Bu sayede yığma jelinde tampon solüsyondan gelen glisin amino asitleri nötr olarak bulunur. [ Konuyla ilgili daha detaylı bilgi edinmek isteyenler amino asitlerin iyonlaşabilen gruplarına bakabilirler. ] ve bu yüzden de + kutuba doğru olan hareketleri çok yavaştır. Onun tam tersine yine tampondan gelen ve negatif yüklü Cl iyonlarının + kutuba doğru olan hareketi çok hızlıdır. Böylece yığma jelinde jele yüklenen proteinler Cl iyonları ile glisin amino asitleri arasında sıkışır. Bu da tüm proteinlerin ayırma jeline aynı anda girmesini sağlar. Kısacası, yığma jelinin görevi herhangi bir ayrışma başlamadan tüm proteinleri aynı çizgide toplamaktır. Yığma jelinin alt kısmında bulunan ayırma jelinin pH'ı ise 8.8'dir. Bu sayede ayırma jelinde glisin amino asitleri negatif yüklenir ve + kutuba doğru oldukça hızlı bir şekilde hareket ederler. Başka bir deyişle, proteinler artık glisin amino asitleri ve Cl iyonları arasında sıkışmış durumda değildir, hareket etmekte ve ayrışmakta özgürdür.
Agaroz jel elektroforezinde de olduğu gibi porlu bir yapıya sahip olan poliakrilamid jel elektroforezinde proteinlerin hareketleri onların yükleri, şekilleri ve büyüklüklerinden etkilenir. Bu kadar çok değişkenin bir araya gelmesi analiz açısından zor olacağı için proteinler jele yüklenmeden önce SDS ve beta-merkaptoethanol ile bir araya getirilir. SDS negatif yüke sahip bir deterjandır ve [yukarıdaki resimde de görülebileceği gibi] hem proteinin katlanmasında rol oynayan kovalent olmayan bağları bozarak proteinlerin şekillerini bozar, onları lineer bir hale getirir hem de tüm proteinleri negatif yükle yükleyerek hepsinin + kutuba doğru hareket etmesini sağlar. Beta-merkaptoethanol ise indirgeyici bir kimyasaldır. İndirgeyici özelliği sayesinde proteinlerin içerdiği disülfit bağlarını bozar yani SDS ile birlikte proteinlerin lineer bir şekil almasını sağlar. Kısacası, beta-merkaptoethanol ve SDS ile muamale edilen proteinler şekillerini kaybeder, negatif yükle yüklenir ve lineer bir hale gelir. Böylece porlu jelde ne kadar süratle hareket edeceklerini sadece büyüklükleri etkiler.
Buraya kadar özetlemek gerekirse, SDS ve beta-merkaptoethanol ile muamele edilen proteinler yığma ve ayırıcı olarak iki katmana sahip olan jele yüklenip elektrik alana maruz kaldığında proteinler büyüklüklerine bağlı olarak farklı hızlarda + kutuba doğru hareket ederler. Bir başka değişle, proteinler büyüklüklerine göre jelde ayrılır. Ve bu ayrışma şu şekilde olur; küçük olan proteinler daha hızlı hareket edebildiğinden jelin daha alt kısımlarında büyük olan proteinler ise daha yavaş hareket ettiğinden jelin daha üst kısımlarında konumlanır.
Bu aşamadan sonra yapılması gereken tek şey proteinleri jelde görünür kılmak ve büyüklüklerini belirlemektir. Proteinleri jelde görünür kılmak için uygulanan 2 temel method vardır; Gümüş nitrat boyama ve coomassie blue boyasıyla boyama. Günümüzde gümüş nitrat boyama hem pahalı olması hem de fazla uğraştırıcı olması sebebiyle laboratuvarlarda çok fazla kullanılmamaktır. Bu tekniğin tek avantajı çok hassas olması yani coomassie blue boyasıyla tespit edilemeyecek proteinleri jelde tespit edebilmesidir. [ Yukarıdaki resim: Gümüş nitrat boyama tekniğiyle boyanan bir jel ]
Coomassie blue boyası lizin ve arjinin başta olmak üzere amino asitlere bağlanır ve mavi renkte bir ışık yayar. Her protein belli bir oranda lizin ve arjinin içerdiğinden dolayı jelin üzerine coomassie blue boyası döküldüğünde ve gerekli yıkamalar yapıldığında boya jelde sadece proteinlerin olduğu yerlerde konumlanır. Böylece de boyamanın ardından yukarıda da görüldüğü gibi protein içeren bantlar mavi renginde görülür. Ayrıca yayılan mavi ışığın şiddeti bandın içerdiği protein miktarına bağlı olduğundan coomassie blue boyasıyla proteinlerin konsantrasyonları tahmin edilebilir, dahası bradford assay methoduyla protein konsantrasyonu belirlenebilir.
Son olarak, tüm bu ayırma işlemlerinden sonra proteinlerin büyüklüğünü belirleyebilmek için jele yükleme yaparken büyüklüğü bilinen proteinler yani protein marker'ı da yüklenmelidir. Böylece yürütme işlemi bittikten sonra büyüklüğü bilinen proteinlerin bantlarıyla bilinmeyen proteinlerin bantları karşılaştırılarak proteinlerin büyüklüğü / ağırlığı belirlenebilir.
* Günümüzde laboratuvarlarda poliakrilamid jel elektroforezi genellikle daha sonra Western Blotting'de kullanmak üzere yapılır. Umarım başka bir yazıda Western Blot'u da anlatabilirim. Sevgiyle ve bilimle kalın :)
Etiketler:
akrilamid,
APS,
ayırma jeli,
beta-merkaptoethanol,
bisakrilamid,
biyoloji,
Coomassie blue,
deney,
elektroforez,
gümüş nitrat boyama,
moleküler biyoloji,
poliakrilamid,
protein,
SDS,
TEMED,
yığma jeli
12 Ocak 2019 Cumartesi
Plazmid
Herhangi bir klonlama deneyine başlarken yapılacak ilk şey neredeyse her zaman plazmid izolasyonudur. Çünkü plazmidler küçük yapıları, bakteriden tutun da insan hücrelerine kadar çok farklı çeşitlilikteki konak hücrelere gönderilebilmesi, üzerinde çok çalışıldığı için modifikasyonlarının kolay olması gibi sebeplerden ötürü moleküler klonlama deneylerinde hep vektör olarak kullanılmaktadır. Ve onları deneylerde kullanabilmek örneğin içine bir gen koyabilmek için öncelikle onları izole etmemiz yani diğer protein ve nükleik asitlerden ayırmamız gerekmektedir.
Plazmid ekstrakromozomal DNA olarak adlandırılan özellikle bakteri ve bazı mayalarda bulunan genomik DNA haricinde hücrede bulunan halkasal DNA'dır. Bu halkasal DNA replikasyon orijini [origin of replication, ori] sayesinde genomik DNA'dan bağımsız olarak replike olur ve yeni oluşan hücrelere dağılımı tamamen rastlantısaldır. Yani yeni oluşan bir hücre bir plazmidin birden fazla kopyasını içerirken diğeri hiç içermeyebilir.
Plazmid normalde yani doğada hücre için elzem olmayan ama gerektiğinde ona avantaj kazandıran genleri taşır. Örneğin, antibiyotik direnç geni, anormal metabolitleri parçalamaya yarayan enzimleri kodlayan genler, restriksiyon enzimlerini kodlayan genler vb. Ama yukarıda da bahsedildiği gibi laboratuvarda vektör olarak kullanılmak üzere izole edilen plazmidler genellikle yapay olarak klonlama için üretilen plazmidlerdir ve onlar amacına göre değişmekle birlikte genelde şunları içerir;
- Ori; plazmidin konak hücrede genomik DNA'dan bağımsız olarak replike olmasını sağlayan replikasyon orijini
- Promotor; eğer plazmid ekspresyon plazmidi ise yani plazmidin içerisine eklenecek olan gen konak hücrede transkripte edilecekse konak hücreye uygun bir promotor plazmidin içerisinde bulunur.
- MCS (Multiple Cloning Site); MCS içerisinde çeşitli restriksiyon enzimleri tarafından tanınacak sekanslar bulunur. Böylece uygun restriksiyon enzimleri hem plazmide hem de PCR ile amplifiye edilmiş gene uygulandığında gen plazmidin içerisine eklenebilir. Ayrıca bazı yapay plazmidlerde MCS'te suicide yani intihar geni bulunur. Bu gen sayesinde restriksiyon enzimleriyle kesildikten sonra gen içeriye alınmadan plazmidin geri kapanması durumunda bu plazmidi içeren bakteriler yaşamayacak böylece de yaşayan bakterilerin kesin olarak geni içerdikleri bilinebilecek.
- Antibiyotik direnç geni; Plazmidin içerisinde bulunan antibiyotik direnç geni bakterilerin transformasyon sonrasında plazmidi alıp almadığını anlamak için kullanılır. Daha detaylı açıklamak gerekirse; transformasyon sonrasında bakteriler antibiyotik içeren agara ekilir. Böylece plazmidi almayan bakteriler antibiyotik yüzünden agarda yetişemez. Plazmidi alanlar ise plazmidde bulunan antibiyotik direnç geni sayesinde agarda yetişebilir, [ Tabii ki transformasyondan sonra agara ekmeden önce bakteriler antibiyotik içermeyen agarda bir süre yetiştirilir. Böylece plazmidi alan bakteriler antibiyotiğe direnç için gerekli proteinleri sentezleyebilir. ] böylece agarda yetişen bakteri kolonileri plazmid içerdikleri bilindikleri için ilerideki deneylerde kullanılabilirler.
Ek olarak, rekombinant DNA teknolojisiyle yani plazmidin içerisine geni koyarak protein üretimi yapılacaksa ve bu proteine karşı izolasyonda kullanılacak bir antikor yoksa genin ardından his-tag, GFP-tag ya da GST-tag içeren plazmidler rekombinant DNA teknolojisinde kullanılabilir. Böylece transformasyondan sonra bu tagler sayesinde üretilen protein izole edilebilir ya da hücre içerisinde takip edilebilir. Örneğin, eğer plazmid MCS'ten yani genin konulacağı bölgeden sonra GFP (Green fluorescent protein, yeşil floresan proteini) proteinini kodlayan geni içeriyorsa, gen plazmidin içerisine konulduktan ve konak hücrede üretilmeye başladıktan sonra GFP proteinine bağlı bir şekilde üretilir. Ve GFP proteini floresan mikroskobu altından yeşil olarak görüldüğünden diğer protein de mikroskop altında gözlemlenebilir.
Ayrıca, plazmidler sadece bir proteini üretmek için kullanılmaz. Bazen de bir hücrede spesifik bir genin ekspresyonunu engellemek için kullanılabilir. Örneğin, bir genin ekspresyonunu engelleyen kodlama yapmayan RNA'yı yani non-coding RNA'yi kodlayan gen plazmidin içerisine konulursa, konak hücrede non-coding RNA üretilir ve bu da spesifik bir genin ekspresyonunu engeller.
Son olarak deneyde kullanmak üzere vektör seçmek veya sadece incelemek isterseniz; https://www.addgene.org/search/advanced/?q= bunun için oldukça iyi bir kaynak. Sevgiyle ve bilimle kalın :)
Kaydol:
Kayıtlar (Atom)
Moleküler Biyoloji ve Hücre Biyolojisi ile İlgili Hafıza Kartları | Memory Cards about Molecular Biology and Cellular Biology 2
Tekrar etmek hem benim uyguladığım ve çok faydalı bulduğum bir teknik hem de bilimsel olarak bir bilginin kalıcı olmasında çok etkili olduğu...
-
Agaroz jel elektroforezi biyoloji dalında özellikle DNA moleküllerini büyüklük ve konformasyonlarına bağlı olarak ayırmada yaygın kullanıla...
-
G-proteine bağlı reseptörler oldukça büyük bir protein ailesini oluşturmaktadır. Örnek vermek gerekirse, insan genomu yaklaşık 800 adet G...
-
Yukarıdaki resimde ökaryotik hücrelerin genomunda bulunan genlerin tipik yapısı gösterilmektedir. DNA düzeyinde incelemeye başlarsak,...